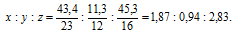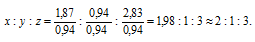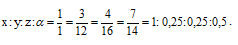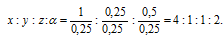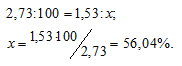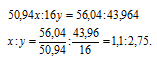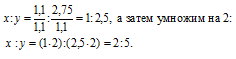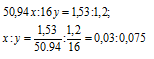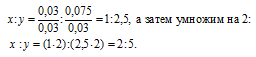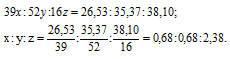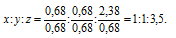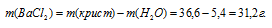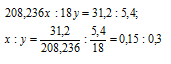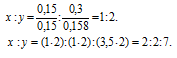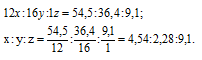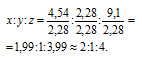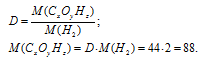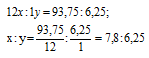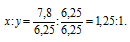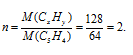- Вывод химических формул различных веществ
- Оксид ванадия (V) — Vanadium(V) oxide
- СОДЕРЖАНИЕ
- Химические свойства
- Восстановление до более низких оксидов
- Кислотно-основные реакции
- Другие окислительно-восстановительные реакции
- Подготовка
- Использует
- Производство феррованадия
- Производство серной кислоты
- Прочие окисления
- Другие приложения
- Биологическая активность
Вывод химических формул различных веществ
Задача 99.
Найти простейшую формулу вещества, содержащего (по массе) 43,4% натрия, 11,3% углерода и 45,3% кислорода.
Решение:
Обозначим числа атомов натрия, углерода и кислорода в простейшей формуле вещества соответственно через x, y и z. Атомные массы этих элементов равны соответственно 23, 12 и 16. Поэтому массы натрия, углерода и кислорода в составе вещества относятся как 23х : 12у : 16z. По условию задачи это отношение имеет вид: 43,4 : 11,3 : 45,3. Следовательно: 23х : 12у : 16z = 43,4 : 11,3 : 45,3.
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них:
Задача 100.
Найти простейшую формулу вещества, в состав которого входят водород, углерод, кислород и азот в соотношении масс 1 : З : 4 : 7.
Решение:
Обозначим числа атомов водорода, углерода, кислорода и азота в простейшей формуле вещества соответственно через x, y, z. Атомные массы этих элементов равны соответственно 1, 12, 16 14. Поэтому массы водорода, углерода, кислорода и азота в составе вещества относятся как 1х : 12у : 16z :14 . По условию задачи это отношение имеет вид: 1 : 3 : 4 : 7. Следовательно: 1х : 12у : 16z :14 = 1 : 3 : 4 : 7.
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них:
Задачи 101.
Найти простейшую формулу оксида ванадия, зная, что 2,73г оксида содержат 1,53г металла.
Решение:
Вариант I.
Находим процентное содержание ванадия в его оксиде из пропорции:
Тогда процентное содержание кислорода составляет; 100 – 56,04 = 43,96%.
Обозначим числа атомов ванадия и кислорода в простейшей формуле оксида соответственно через x и y. Атомные массы этих элементов равны соответственно 50,94 и 16. По-этому массы ванадия и кислорода в составе оксида относятся как 50,94x : 16y. По условию задачи это отношение равно 56,94 : 43,96. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
Таким образом, простейшая формула оксида ванадия имеет вид; V2O5.
Вариант II.
Решение:
Находим массу кислорода в оксиде ванадия: m(O) 2,73 — 1,53 = 1,2г.
Обозначим числа атомов ванадия и кислорода в простейшей формуле оксида соответственно через x и y. Атомные массы этих элементов равны соответственно 50,94 и 16. Поэтому массы ванадия и кислорода в составе оксида относятся как 50,94x : 16y. По условию задачи это отношение в 2,73г оксида ванадия равно 1,53 : 1,2. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
Задача 102.
Вещество содержит (по массе) 26,53% калия, 35,37% хрома и 38,10% кислорода. Найти его простейшую формулу.
Решение:
Обозначим числа атомов калия, хрома и кислорода в простейшей формуле вещества через x, y и z. Атомные массы этих элементов равны соответственно 39, 52 и 16. Поэтому массы калия, хрома и кислорода в составе вещества относятся как 39x : 52y : 16z. По условию задачи это отношение равно 26,53 : 35,37 : 38,10. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим три его члена на наименьший из них:
а затем умножим три члена последнего отношения на 2, получим:
x : y = (1 . 2) : (1 . 2) : (3,5 . 2) = 2 : 2 : 7.
Таким образом, простейшая формула вещества имеет вид: K2Cr2O7.
Задача 103.
Найти формулу кристаллогидрата хлорида бария, зная, что 36,6г соли при прокаливании теряют в массе 5,4г.
Решение:
Молекулярные массы хлорида бария и воды соответственно равны 208, 236 и 18г/моль.
Находим массу хлорида бария в кристалле:
Обозначим числа молекул хлорида бария и воды в кристаллогидрате хлорида бария соответственно через z и y, получим формулу xBaCl2 . yH2O. Массы молекул хлорида бария и воды в составе кристаллогидрата относятся как 208,236x : 18y. По условию задачи это отношение равно 31,2 : 5,4. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим два его члена на наименьший из них:
Таким образом, простейшая формула кристаллогидрата ( x BaCl 2 . y H 2 O ) будет иметь вид: BaCl2 . 2H2O.
Ответ: BaCl2 . 2H2O.
Задача 104.
Найти молекулярную формулу масляной кислоты, содержащей (по массе) 54,5% углерода, 36,4% кислорода и 9,1% водорода, зная, что плотность ее паров по водороду равна 44.
Решение:
Обозначим числа атомов углерода, кислорода и водорода в простейшей формуле масляной кислоты через x, y и z. Атомные массы этих элементов равны соответственно 12, 16 и 1. Поэтому массы калия, кислорода и водорода в составе вещества относятся как 12x : 16y : 1z. По условию задачи это отношение равно 54,5 : 36,4 : 9,1. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим три его члена на наименьший из них:
Обозначим формулу масляной кислоты как CxOyHz, тогда простейшая формула будет иметь вид: C2OH4. Этой формуле отвечает молекулярная масса 44. Истинную молекулярную массу кислоты находим исходя из её плотности по водороду:
Таким образом, истинная молекулярная масса кислоты отличается от вычисленной молекулярной массы по её простейшей формуле. Вычислим множитель (n), на который следует умножить значения всех трёх членов коэффициентов в простейшей формуле кислоты, разделив значение MCxOyHz на значение MC2OH4:
x : y : z = (2 . 2) : (2 . 1) : (2 . 4) = 4 : 2 : 8. .
Задача 105.
Найти молекулярную формулу вещества, содержащего (по массе) 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41.
Решение:
Молекулярная масса воздуха равна 29 г/моль.
Обозначим числа атомов углерода и водорода в простейшей формуле вещества через x, y. Атомные массы этих элементов равны соответственно 12 и 1. Поэтому массы углерода и водорода в составе вещества относятся как 12x : 1y. По условию задачи это отношение равно 93,75 : 6,25. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
а затем умножим оба члена последнего отношения на 4, получим:
x : y = (1,25 . 4) : (1 . 4) = 5 : 4.
Простейшая формула вещества имеет вид: C5H4. Этой формуле отвечает молекулярная масса, равная 64 [M(С5H4) = (5 . 12) . (4 . 1) = 64)]. Истинную молекулярную массу вещества находим исходя из его плотности по воздуху:
M(CxHy) = D . M(Возд.) = 4,41 . 29 = 128
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
Теперь найденные значения x и y умножаем на 2, получаем: nCxHy = C10H8.
Источник
Оксид ванадия (V) — Vanadium(V) oxide
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК |
- 1314-62-1
Y
- ЧЕБИ: 30045
Y
- 14130
Y
- C19308
N
- BVG363OH7A
Y



23 мг / кг (мышь, перорально)
70 мг / м 3 (крыса, 2 часа)
 N проверить ( что есть ?)
N проверить ( что есть ?)  Y
Y  N
NОксид ванадия (V) ( ванадий ) представляет собой неорганическое соединение с формулой V 2 O 5 . Обычно известный как пятиокись ванадия , это твердое вещество коричневого / желтого цвета, хотя при осаждении из водного раствора его цвет становится темно-оранжевым. Из-за высокой степени окисления он является как амфотерным оксидом, так и окислителем . С промышленной точки зрения, это наиболее важное соединение ванадия , являющееся основным предшественником сплавов ванадия и широко используемым промышленным катализатором.
Минеральная форма этого соединения — щербинаит — встречается крайне редко, почти всегда встречается среди фумарол . Минеральный тригидрат V 2 O 5 · 3H 2 O также известен под названием навахоит.
СОДЕРЖАНИЕ
Химические свойства
Восстановление до более низких оксидов
При нагревании смеси оксида ванадия (V) и оксид ванадия (III) , конпропорционирование происходит с получением оксида ванадия (IV) , в виде темно-синее твердое вещество:
Восстановление также может осуществляться с помощью щавелевой кислоты , монооксида углерода и диоксида серы . Дальнейшее восстановление с использованием водорода или избытка CO может привести к образованию сложных смесей оксидов, таких как V 4 O 7 и V 5 O 9, прежде чем будет получен черный V 2 O 3 .
Кислотно-основные реакции
V 2 O 5 представляет собой амфотерный оксид. В отличие от большинства оксидов металлов, он слегка растворяется в воде с образованием бледно-желтого кислого раствора. Таким образом, V 2 O 5 реагирует с сильными невосстанавливающими кислотами с образованием растворов, содержащих бледно-желтые соли, содержащие центры диоксованадия (V):
Он также реагирует с сильной щелочью с образованием полиоксованадатов , которые имеют сложную структуру, которая зависит от pH . Если используется избыток водного гидроксида натрия , продукт представляет собой бесцветную соль , ортованадат натрия , Na 3 VO 4 . Если кислоту медленно добавлять к раствору Na 3 VO 4 , цвет постепенно становится более глубоким от оранжевого до красного, прежде чем коричневый гидратированный V 2 O 5 выпадет в осадок около pH 2. Эти растворы содержат в основном ионы HVO 4 2- и V 2 O 7 4. — между pH 9 и pH 13, но ниже pH преобладают более экзотические виды, такие как V 4 O 12 4- и HV 10 O 28 5- ( декаванадат ).
При обработке тионилхлоридом он превращается в летучий жидкий оксихлорид ванадия , VOCl 3 :
Другие окислительно-восстановительные реакции
Ванадаты или соединения ванадила в растворе кислоты восстанавливаются амальгамой цинка по красочному пути:
Все ионы в разной степени гидратированы.
Подготовка
Технический V 2 O 5 производится в виде черного порошка, используемого для производства металлического ванадия и феррованадия . Ванадиевая руда или обогащенный ванадием остаток обрабатывают карбонатом натрия и солью аммония для получения метаванадата натрия , NaVO 3 . Затем этот материал подкисляют до pH 2–3, используя H 2 SO 4, с получением осадка «красной лепешки» (см. Выше ). Затем красный кек плавят при 690 ° C с получением неочищенного V 2 O 5 .
Оксид ванадия (V) образуется при нагревании металлического ванадия с избытком кислорода , но этот продукт загрязнен другими, низшими оксидами. Более удовлетворительная лабораторная подготовка включает разложение метаванадата аммония при 500-550 ° C:
Использует
Производство феррованадия
В количественном отношении оксид ванадия (V) преимущественно используется в производстве феррованадия (см. Выше ). Оксид нагревают железным ломом и ферросилицием с добавлением извести для образования силикатно-кальциевого шлака . Алюминий также может быть использован для производства сплава железа с ванадием вместе с глиноземом в качестве
Производство серной кислоты
Еще одним важным применением оксида ванадия (V) является производство серной кислоты , важного промышленного химического вещества, годовое мировое производство которого в 2001 году составило 165 миллионов тонн, а приблизительная стоимость — 8 миллиардов долларов США. Оксид ванадия (V) служит решающей цели — катализировать умеренно экзотермическое окисление диоксида серы до триоксида серы воздухом в контактном процессе :
Открытие этой простой реакции, для которой V 2 O 5 является наиболее эффективным катализатором, позволило серной кислоте стать дешевым товарным химическим веществом, которым она является сегодня. Реакцию проводят при температуре от 400 до 620 ° C; ниже 400 ° C V 2 O 5 неактивен как катализатор, а выше 620 ° C он начинает разрушаться. Поскольку известно, что V 2 O 5 может быть восстановлен до VO 2 с помощью SO 2 , один из вероятных каталитических циклов выглядит следующим образом:
Он также используется в качестве катализатора при селективном каталитическом восстановлении (SCR) выбросов NO x на некоторых электростанциях . Из-за его эффективности в преобразовании диоксида серы в триоксид серы и, следовательно, в серную кислоту, при сжигании серосодержащего топлива необходимо соблюдать особую осторожность при рабочих температурах и размещении блока СКВ на электростанции.
Прочие окисления
Малеиновый ангидрид получают путем катализируемого V 2 O 5 окисления бутана воздухом:
Малеиновый ангидрид используется для производства полиэфирных и алкидных смол .
Фталевый ангидрид получают аналогичным образом катализируемым V 2 O 5 окислением орто-ксилола или нафталина при 350–400 ° C. Уравнение для окисления ксилола:
Фталевый ангидрид является предшественником пластификаторов , используемых для придания полимерам пластичности .
Аналогичным образом производится множество других промышленных соединений, включая адипиновую кислоту , акриловую кислоту , щавелевую кислоту и антрахинон .
Другие приложения
Благодаря высокому коэффициенту термического сопротивления оксид ванадия (V) находит применение в качестве материала детектора в болометрах и массивах микроболометров для тепловидения . Он также находит применение в качестве датчика этанола на уровнях ppm (до 0,1 ppm).
Ванадиевые окислительно-восстановительные батареи — это тип проточных батарей, используемых для хранения энергии, в том числе на крупных энергетических объектах, таких как ветряные электростанции .
Биологическая активность
Оксид ванадия (V) проявляет очень умеренную острую токсичность для человека с LD50 около 470 мг / кг. Наибольшая опасность возникает при вдыхании пыли, где LD50 колеблется в пределах 4–11 мг / кг при 14-дневном воздействии. Ванадат ( В.О. 3-
4 ), образующийся в результате гидролиза V 2 O 5 при высоком pH, по-видимому, ингибирует ферменты, перерабатывающие фосфат (PO 4 3- ). Однако способ действия остается неуловимым.
Источник