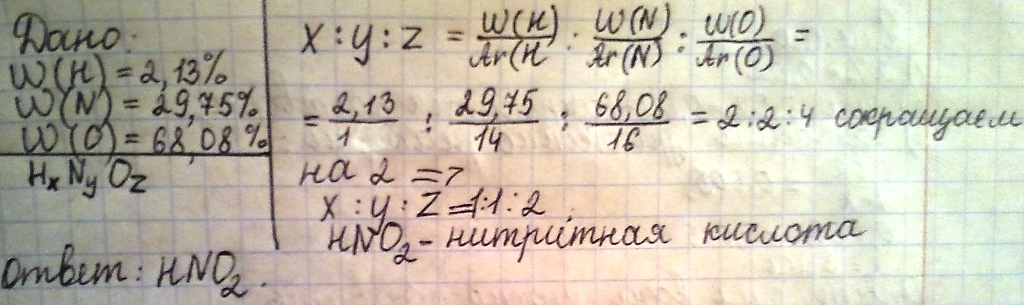- Выведите формулу кислоты если известно что
- Как написать хороший ответ?
- Выведите формулу кислоты если известно что
- Как написать хороший ответ?
- Методы решения задач по химии. Задачи на вывод химической формулы вещества
- Химия, часть С. Задача С5. Определение формул органических веществ.
- Типы задач в задании С5.
- Необходимые теоретические сведения.
- Определение формул веществ по массовым долям атомов, входящих в его состав.
- Определение формул веществ по продуктам сгорания.
- Определение формул веществ по химическим свойствам.
Выведите формулу кислоты если известно что
Вопрос по химии:
выведите формулу кислоты, если известно, что в ее состав входят 2,13% водорода, 29,75% азота, 68,08%кислорода.
Ответы и объяснения 2
n(H):n(N):n(O)=w(H)/Ar(H):w(N)/Ar(N):w(O)/Ar(O)=2,13/1:29,75/14:68,08/16=2:2:4 или 1:1:2,т.е. формула кислоты — HNO2 — это нитритная кислота
Решение на изображении:
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник
Выведите формулу кислоты если известно что
Вопрос по химии:
выведите формулу кислоты, если известно, что в её состав входят 2,13% водорода, 29,79% азота и 68,08% кислорода.
Ответы и объяснения 1
Записываем формулу кислоты HxNyOz
X:Y:Z = (2,13/1) : (29,78/14) : (68.08/16)
X:Y:Z = 2,13 : 2,08 : 4,25
X:Y:Z = 1 : 1 : 2
Это азотистая кислота HNO2
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник
Методы решения задач по химии. Задачи на вывод химической формулы вещества
Разделы: Химия
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Вывод химической формулы вещества:
Номер задачи
(пример решения)
Вычисление молярной массы вещества
Задачи для самостоятельного решения
— на основании массовых долей (%) атомов элементов
M
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3
— на основании массовых долей (%) атомов элементов и плотности соединения
М (CхНу) = D(Н2) ·М (Н2)
Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О
— по плотности вещества в газообразном состоянии
М (в-ва) = ρ · М (газообр. в-ва)
Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О
— на основании массовых долей (%) атомов элементов и массе соединения
М находится по соотношению,
или
M
Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода.
Ответ: C3Н8
— по массе или объёму исходного вещества и продуктам горения
М (в-ва)=Vm·ρ
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О
Приводится пример решения задачи № 6 на применение уравнения Менделеева – Клайперона
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
Решение:
Рассчитать молярную массу кислоты CnН2n (N Н2) CОOH
w (О) =
M кислоты 
Найти число атомов углерода в молекуле кислоты и установить её формулу М = 12 n + 2 n + 16 + 45 =75
14 n = 14, n = 1
Ответ: формула кислоты NН2CН2CОOH
М (NН2CН2 CОOH) = 75 г/моль
Вывести формулу соединения
CnН2n (N Н2) CОOH
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
Дано:
w (С) = 85,7 %
w (Н) = 14,3 %
D Н2 (CхНу) = 21
- Находим относительную молярную массу углеводорода, исходя из величины его относительной плотности: М (CхНу)=D (Н2) ·М (Н2)

m (Н) = 42г. /100% · 14,3 %= 6 г.
Находим количество вещества атомов углерода и водорода
n (С) = 36г :12 г/моль = 3 моль
n (Н) = 6г.: 1 г/моль = 6 моль
Ответ: истинная формула вещества C3Н6.
Вывести формулу соединения
CхНу- ?
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
Дано:
Пары алкана в 2,5 раза тяжелее аргона
Решение:
По относительной плотности можно найти молярную массу алкана: М (C n Н 2 n + 2) = 14 n + 2 = 2,5 · М(Ar) = 100 г/моль
Откуда n = 7.
Ответ: формула алкана C7Н14
Вывести формулу алкана
C n Н2 n + 2
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
Дано:
w (С) = 39,97 %
w (Н) = 6,73 %
w (0) = 53,30 %
Vн.у. (CхHуОz) = 300 мл.
m (CхHуОz) = 2,41 г.
Решение:
Для расчёта выбираем 100г. соединения. Тогда масса углерода равна 39,97 г; водорода 6,73 г; кислорода 53,30 г.
1. Определяем количество вещества:
n (С) = 39,97г :12 г/моль = 3,33 моль
n (Н) = 6,73г.: 1,008 г/моль = 6,66 моль
n (0) = 53,3г.: 16 г/моль = 3,33 моль
Определяем наименьшее общее кратное – 3,33.
n (С) : n (Н) : n (0) = 1 : 2 : 1
Простейшая формула соединения – CH2О
М (CH2О) = 30 г/моль
Определяем молярную массу соединения по соотношению:
0,3 л. – 2,41 г.
22,4 л. – х г.
х = (22,4 · 2,41)/0,3 = 180
Или по формуле М= Vm · m/ V
К = 180 : 30 = 6
Определяем молекулярную формулу соединения, умножая стехиометрические коэффициенты в простейшей формуле на 6.
Ответ: искомая формула — C6H12О6
Вывести формулу соединения
CхНуОz- ?
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
Дано:
M (CхHу) = 4,4 г.
ρ (н.у.) = 1,97 г/л
V (СО2) = 6,72 л.
m (Н2О) = 7,2 г.
Решение:
1. Находим относительную молярную массу углеводорода, исходя из величины его относительной плотности:
М (CхHу) = Vm · ρ
М (CхHу) = 22,4л/моль · 1,97г/л = 44г/моль
2. Записываем в алгебраическом виде уравнение реакции горения газа, выразив коэффициенты через х и у.
Составляем пропорции:
4,4 / 44 = 6, 72/ х · 22,4
х = 44 · 6, 72/ 4,4 · 22,4 = 3
у = 44 · 7,2/ 4,4 · 9 = 8
Формула соединения C3H8; М (C3H8) = 44 г/моль
Ответ: молекулярная формула соединения C3H8
Вывести формулу
CхHу — ?
Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
Дано:
w (S) = 62,8 %
w (F) = 37,2 %
m (CхHу) = 0,51 г
V (CхHу) = 118 мл.
Т = 70
Р = 98,64 кПа
- Определяем простейшую формулу соединения:
n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1
Простейшая формула S F
- Находим молярную массу соединения:
M
Следовательно, формула соединения S2 F2
Источник
Химия, часть С. Задача С5. Определение формул органических веществ.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)
Если записать эту формулу в общем виде, то получится следующее выражение:
| Массовая доля атома Э в веществе = | Атомная масса атома Э | • | число атомов Э в | молекуле |
| Аr(Э) • z | ||||
| —————— | ||||
| Mr(вещ.) | ||||
| Молекулярная масса вещества | ||||
Молекулярная и простейшая формула вещества.
Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.
| Вещество | Молекулярная формула | Соотношение атомов | Простейшая формула |
| Этанол | С2Н6О | С:Н:О = 2:6:1 | С2Н6О |
| Бутен | С4Н8 | С:Н = 1:2 | СН2 |
| Уксусная кислота | С2Н4О2 | С:Н:О = 1:2:1 | СН2О |
Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29
Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm ,
а молярную массу газа можно найти, умножая плотность на молярный объём.
Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
| Класс органических веществ | Общая молекулярная формула | Формула с выделенной кратной связью и функциональной группой | ||||||||||
| Алканы | CnH2n+2 | — | ||||||||||
| Алкены | CnH2n | CnH2n+1–CH=CH2 | ||||||||||
| Алкины | CnH2n−2 | CnH2n+1–C≡CH | ||||||||||
| Диены | CnH2n−2 | — | ||||||||||
| Гомологи бензола | CnH2n−6 | С6Н5–СnH2n+1 | ||||||||||
| Предельные одноатомные спирты | CnH2n+2O | CnH2n+1–OH | ||||||||||
| Многоатомные спирты | CnH2n+2Ox | CnH2n+2−x(OH)x | ||||||||||
| Предельные альдегиды | CnH2nO |
| ||||||||||
| Кетоны | CnH2nO |
| ||||||||||
| Фенолы | CnH2n−6O | С6Н5(СnH2n)–OH | ||||||||||
| Предельные карбоновые кислоты | CnH2nO2 |
| ||||||||||
| Сложные эфиры | CnH2nO2 |
| ||||||||||
| Амины | CnH2n+3N | СnH2n+1NH2 | ||||||||||
| Аминокислоты (предельные одноосновные) | CnH2n+1NO2 |
|
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Решение примера 1.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•10 23 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•10 22 / 6,02•10 23 = 0,05 моль ,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль .
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль.
При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду.
Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.
В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0 , т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2.
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2→ CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
Масса всего вещества 9,8 г.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
Определение формул веществ по химическим свойствам.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2→ СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
| 0,005 | 0,01 | |
| СnH2n−2 | + 2Br2 → | СnH2n−2Br4 |
Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль .
Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH .
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:
Получим два уравнения, из которых найдём m и n:
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH .
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1 .
Это аланин — аминопропановая кислота.
Источник