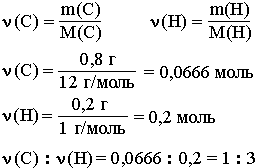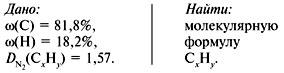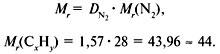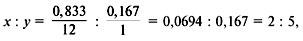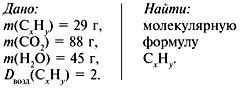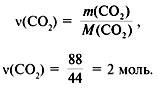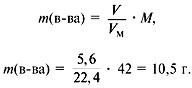- Выведите молекулярную формулу вещества если при сжигании 4 2 г
- Как написать хороший ответ?
- Вывод молекулярной формулы вещества по продуктам сгорания. Задачи.
- Просмотр содержимого документа «Вывод молекулярной формулы вещества по продуктам сгорания. Задачи.»
- Алгоритм решения задач на нахождение молекулярной формулы газообразного углеводорода
- Просмотр содержимого документа «Алгоритм решения задач на нахождение молекулярной формулы газообразного углеводорода»
Выведите молекулярную формулу вещества если при сжигании 4 2 г
Вопрос по химии:
Выведите молекулярную формулу органического вещества , если при сжигании 4,2 г его образовалось 13,2 г оксида углерода 4 и 5,4воды относительная плотность паров этого вещества по воздуху = 2,9
Можно вместе с ДАНО пожалуйста)))
Ответы и объяснения 1
Решения:
M(CnHmOz)=29*2,9≈84г/моль
n(CO2)=13,2/44=0,3моль
n(H2O)=5,4/18=0,3моль
выделялись одинаковые количества CO2 и H2O, тогда: m=2n
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник
Вывод молекулярной формулы вещества по продуктам сгорания. Задачи.

Вывод молекулярной формулы вещества по продуктам сгорания. Примеры решения данного тиа задач.
Просмотр содержимого документа
«Вывод молекулярной формулы вещества по продуктам сгорания. Задачи.»
Вывод молекулярной формулы вещества по продуктам сгорания.
При полном сгорании 4,6 г газообразного органического вещества получено 8,8 г СО2 и 5,4 г Н2О. Относительная плотность паров вещества по воздуху равна 1,589. Определите молекулярную формулу вещества и дайте названия всем его изомерам.
в состав сгораемого вещества обязательно входят углерод и водород, но возможно наличие кислорода. Поэтому, необходимо сделать проверку на кислород:
ν(СО2)=m/M=8,8 г/44 г/моль=0,2 моль; ν(С)=0,2 моль;m(С)=2,4 г
ν(Н2О)=m/M=5,4 г/18 г/моль=0,3 моль; ν(Н)=0,6моль; m(Н)=0,6 г
m(C)+m(H)=2,4 г + 0,6 г=3 г
а вещества сгорело 4,6 г, следовательно, имеется кислород.
ν(О)=1,6 г/16 г/моль=0,1моль
Находим среди этих цифр самое маленькое и все делим на него, получая: х:y:z= 2:6:1
М (в-ва)= D(воздуху)×М(воздуха)=1,589×29 г/моль=46 г/моль
что соответствует действительности.
^ Ответ: С2Н6О. Это либо этиловый спирт, либо диметиловый эфир.
При сгорании углеводорода получено 0,2 моль СО2 и 0,2 моль Н2О. Определите молекулярную формулу углеводорода, если известно, что 3,64 г этого вещества занимают объем 1,456 л (н.у.).
(здесь конкретно указано, что горит углеводород).
х,y- коэффициенты перед формулами веществ в правой части — это индексы при углероде и водороде в сгоревшем веществе.
ν(СО2):ν(Н2О)=х:0,5y (по уравнению), а на самом деле как 0,2:0,2 (по условию)
Раз имеется два неизвестных, то должна быть система уравнений. Второе уравнение даст молярная масса вещества:
Через объем найдем количество углеводорода, а затем его молярную массу:
ν= V/Vm=1,456 л/22,4 л/моль=0,065 моль
M=m/ν=3,64 г/0,065 моль=56 г/моль
Вместо (х) подставляем его значение из уравнения (1)
В состав вещества входят С,Н,О,S. При сжигании его навески массой 0,222 г были получены 0,396 г СО2, 0,162 г Н2О, а сера переведена в сульфат бария массой 0,3495 г. Относительная плотность паров вещества по водороду равна 74. Определить истинную формулу вещества.
в-во+ О2→ СО2+Н2О +SО2 (любое вещество, содержащее серу, дает при сгорании диоксид серы),
SО2→ ВаSО4 (через какие реакции осуществлен данный переход — неважно, из сульфата бария надо найти массу и количества серы).
ν(СО2)=m/M=0,396 г/44 г/моль=0,009 моль;ν(С)=0,009 моль; m(С)=0,108 г;
ν(Н2О)=m/M=0,162 г/18 г/моль=0,009 моль;ν(Н)=0,018 моль; m(Н)=0,018 г;
ν(ВаSО4)=m/M=0,3495 г/233 г/моль=0,0015 моль; ν (S)=0,0015 моль; m(S)=0,048 г;
m(О)=0,222-0,108-0,018-0,048 г=0,048 г;
ν(О)=0,048 г/16 г/моль=0,003 моль;
Находим среди этих цифр самое маленькое и все делим на него, получая: х:y:z:q= 6:12:2:1
М (в-ва)= D(по водороду)×М(Н2)=74×2 г/моль=148 г/моль
что соответствует действительности.
При сгорании газообразного органического вещества, не содержащего кислород, выделилось 2,24 л (н.у.) углекислого газа, 1,8 г воды и 3,65 г хлороводорода. Установите формулу сгоревшего вещества, рассчитайте его объем и массу.
В задаче сказано, что вещество не содержит кислород, следовательно, оно состоит только из углерода, водорода и хлора:
в этой задаче необходимо найти количество углерода, перешедшего в углекислый газ, количество водорода, перешедшего как в воду, так и в хлороводород, количество хлора из хлороводорода:
х:y:z= ν (C): ν (Н): ν (Cl)
ν (Н2О)=m/M=1,8 г/18 г/моль=0,1 моль; ν (Н)=0,2 моль;
ν (НCl)=m/M=3,65 г/36,5 г/моль=0,1 моль; ν (Cl)=0,1 моль;
ν (Н)общее=0,1 моль+0,2 моль=0,3 моль
х:y:z= ν (C): ν (Н): ν (Cl)=0,1:0,3:0,1
Находим среди этих цифр самое маленькое и все делим на него, получая: х:y:z= 1:3:1
Для нахождения массы и объема сгоревшего вещества, необходимо составить количественные соотношения между хлорметаном и любым продуктом реакции:
m(СН3Сl)=М× ν =50,5 г/моль×0,1 моль=5,05 г
Неизвестное органическое вещество массой 0,4 г сожгли и продукты сгорания пропустили через трубку с безводным сульфатом меди (II) и сосуд, содержащий избыток баритовой воды. Масса трубки увеличилась на 0,36 г, в сосуде образовался осадок массой 5,91 г. Установить формулу вещества.
В состав сгораемого вещества обязательно входят углерод и водород, но возможно наличие кислорода. Поэтому необходимо сделать проверку на кислород.
Масса трубки с сульфатом меди (II) увеличилась за счет поглощенной воды (CuSО4 + nН2О→CuSО4×nН2О), откуда делаем вывод, что масса выделившейся воды равна 0,36 г.
С баритовой водой (Ва(ОН)2) взаимодействует СО2):
ν(ВаСО3)=m/M=5,91 г/197 г/моль=0,03 моль;
ν(С)=0,03 моль, m(С)=0,36 г
ν(Н2О)=m/M=0,36 г/18 г/моль=0,02 моль; ν(Н)= 0,04 моль;
следовательно, кислорода нет.
СхНy х:y= ν(C): ν(Н)=0,03:0,04 (можно умножить все на 100)
Смесь газов, образовавшихся при сжигании образца органического соединения Х массой 2,7 г, была пропущена последовательно через склянки с концентрированной серной кислотой и известковой водой. При этом масса первой склянки увеличилась на 3,78 г, во второй склянке образовалось 12 г осадка, а объем непоглощенного газаY составил 733 мл (25 0 С и нормальное давление). При одновременном добавлении к такому же образцу вещества Х избытка раствора нитрита натрия и соляной кислоты выделяется вдвое больший объем газа Y. Определите неизвестное вещество Х и приведите его структурную формулу.
Газ, который не поглощается известковой водой — это азот. Следовательно, в состав неизвестного вещества обязательно входят углерода, водород, азот и возможно, кислород.
Масса склянки с конц. Н2SО4 увеличивается за счет поглощения кислотой воды, m(Н2О)=3,78 г
С известковой водой взаимодействует углекислый газ:
ν(СаСО3)=m/M=12 г/100 г/моль=0,12 моль;
Проверка на кислород:
ν(СО2)=0,12 моль; ν(С)=0,12 моль;m(С)=1,44 г
ν(Н2О)=m/M=3,78 г/18 г/моль=0,21 моль; ν(Н)=0,42 моль;
Приведем объем азота к н.у., учитывая, что Т=(273 +25)К=298 К
По «объединенному газовому закону»
m(C)+m(H)+m(N)=1,44 г + 0,42 г+0,84=2,7 г
кислорода нет, так как вещества сгорело тоже 2,7 г.
Находим среди этих цифр самое маленькое и все делим на него, получая: х:y:z= 2:7:1
С2Н7N-амин. Это может быть либо первичный амин С2Н5NН2, либо вторичный амин (СН3)2NН.
Установить его структуру поможет реакция с азотистой кислотой. Только первичные амины вступают в реакцию с НNО2 по уравнению:
Задачи для самостоятельного решения.
1.При сжигании 3,7 г монофункционального органического вещества было получено 2,7 г воды и 3,36 л (н.у.) диоксида углерода. Какое это вещество, если при взаимодействии его с натрием выделяется водород, а водный раствор продукта реакции окрашивает лакмус в синий цвет? Составить уравнение реакции взаимодействия с натрием.
2. Относительная плотность паров органического соединения по гелию равна 25,5. При сжигании 15,3 г этого вещества образовалось 20,16 л (н.у.) углекислого газа и 18,9 г воды. Выведите молекулярную формулу органического соединения. К каким классам органических соединений может относиться данное вещество?
3.При полном сгорании 4,8 г органического вещества, плотность паров которого по водороду равна 16, получили 6,6 г диоксида углерода и 5,4 г воды. Каковы формула и названия этого вещества?
Составить не менее трех уравнений реакций получения данного вещества.
4.При полном сгорании 0,88 г органического соединения образовалось 896 мл СО2 (н.у.) и 0,72 г воды. Выведите молекулярную формулу этого вещества, если плотность паров по водороду равна 44. Укажите, к каким классам может относиться это вещество. Найти все изомеры данного вещества.
5. При сжигании вещества массой 10,7 г получили 30,8 г углекислого газа, 8,1 г воды и 1,4 г азота. Плотность паров этого вещества по воздуху равна 3,69. Определите молекулярную формулу вещества.Составить уравнение реакции данного вещества с хлороводородом, дать название образующемуся продукту.
6.При сгорании 0,9 г газообразного органического вещества выделилось 0,896 л (н.у.) углекислого газа, 1,26 г воды и 0,224 л (н.у.) азота. Плотность газообразного вещества по азоту 1,607. Установите молекулярную формулу органического вещества и приведите одно из возможных названий. Привести не менее трех уравнений реакций получения данного вещества.
7.При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л углекислого газа, 0,63 г воды и 0,112 л азота.Объемы газов измерялись при нормальных условиях. Плотность газообразного вещества по азоту 1,607. Установите его молекулярную формулу и приведите одно из возможных названий этого соединения. С какими из перечисленных соединений может взаимодействовать это вещество: а) метаном; б) гидроксидом бария; в) водой; г) кислородом; д) бензолом; е) азотной кислотой. Составить уравнения данных реакций.
8.При полном сгорании 0,62 г газообразного органического вещества выделилось 0,448 л углекислого газа, 0,9 г воды и 0,224 л азота (объемы газов измерены при нормальных условиях). Плотность вещества по водороду 15,50. Установите его молекулярную формулу и назовите это соединение. Это вещество может быть получено при взаимодействии:
Составить уравнения осуществимых реакций.
9.Сожгли 6 г вещества и получили 6,72 л углекислого газа (н.у.) и 7,2 г воды. Относительная плотность паров вещества по воздуху равна 2,07. Определить молекулярную формулу вещества. Для этого вещества характерны реакции:
а) этерификации б) поликонденсации в) нейтрализации
г) окисления д) дегидратации е) гидратации.
10.Относительная плотность паров органического вещества по водороду равна 30. При сжигании 24 г вещества образовались 35,2 г оксида углерода (IV) и 14,4 г воды. Определить молекулярную формулу вещества. Составить уравнения реакций получения данного вещества в лаборатории и промышленности.
11.Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения. К каким классам органических соединений оно может относиться?
12.При сгорании вещества массой 8,5 г образовались оксид углерода (IV) массой 26,4 г и вода массой 11,7 г. Плотность паров вещества по воздуху равна 5,862. Определите формулу вещества.
Источник
Алгоритм решения задач на нахождение молекулярной формулы газообразного углеводорода

Алгоритм решения задач на нахождение молекулярной формулы газообразного углеводорода, составлен с помощью разработок по данной теме в Интернет, в помощь обучающимся в 10 классе.
Просмотр содержимого документа
«Алгоритм решения задач на нахождение молекулярной формулы газообразного углеводорода»
Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению 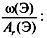
4. Записать простейшую формулу: С3Н8.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
1. Записать условие задачи.
2. Найти массовую долю водорода:
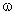
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:


5. Найти количество вещества воды:

6. Найти количество вещества водорода в сожженном веществе:



7. Найти простейшую формулу углеводорода:


следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:


4. Найти количества веществ воды и водорода:


5. Найти сумму масс углерода и водорода:
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:


следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Cоставим выражение для расчета массовой доли хлора:
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
СН3 – СCl – СН3 2-метил-2-хлорпропан
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Находим количество вещества алкена:
По уравнению реакции
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода.
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана.
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
Источник