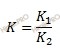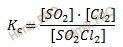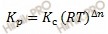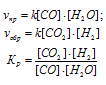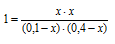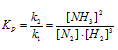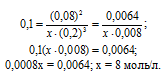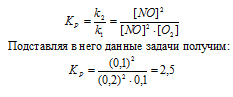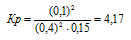- Химик.ПРО – решение задач по химии бесплатно
- Решение задачи
- Как правильно рассчитывать равновесные концентрации веществ. Смещение равновесия реакции
- Напишите выражение для константы равновесия процессов:
- Вычисление константы равновесия системы
- Константа равновесия для гомогенной реакции
- Смещение равновесия схимической системы
Химик.ПРО – решение задач по химии бесплатно
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) В сторону расходования или образования хлора сдвигается равновесие при: а) увеличении концентрации диоксида серы; б) увеличении температуры; в) введении катализатора.
Решение задачи
Константой химического равновесия (Kр) отношение констант скоростей прямой и обратной реакций.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ (исходных и продуктов), участвующих в реакции, связаны между собой. Изменение концентрации любого из них влечет за собой изменения концентрации всех остальных веществ. Концентрации веществ при установившемся равновесии называются равновесными концентрациями.
Константу равновесия можно выразить через молярные концентрации веществ, участвующих в реакции. В этом случае она обозначается Кс. Константа равновесия данной реакции выражается уравнением. Запишем выражение константы равновесия:
Если же выразить константу равновесия через парциальные давления газообразных веществ, участвующих в реакции, то её обозначают Кр и она будет равна для приведенной формальной реакции:
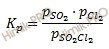
Константы Кс и Кр связаны между собой соотношением:
∆n – изменение числа молей реагирующих веществ и продуктов в результате реакции.
Если ∆n = 0, то есть реакция не сопровождается изменением числа молей компонентов, то
2) Если увеличить концентрацию диоксида серы (SO2) равновесие сместится в сторону обратной реакции (в сторону расходования хлора (Cl2)).
Увеличение температуры влечет смещение равновесия в в сторону прямой реакции (в сторону образования хлора (Cl2)).
Введение катализатора одинаково ускоряет и прямую и обратную реакции и поэтому не происходит смещение химического равновесия. Катализатор только способствует более быстрому достижению состояния равновесия.
Источник
Как правильно рассчитывать равновесные концентрации веществ. Смещение равновесия реакции
Задача 249.
Для предложенной обратимой реакции напишите математическое выражение константы химического равновесия и укажите направление смещения равновесия при изменении условий:
а) уменьшении концентрации одного из газообразных продуктов;
б) понижении давления в системе;
в) повышении температуры в системе.
2Н2(г) + О2(г) ⇔ 2Н2O(г); ∆Hx.p. = -484кДж.
Решение:
Кр можно выразить через соотношение констант прямой и обратной реакций, получим:
а) Понижение концентрации продукта реакции (отведение из системы Н2О) будет увеличивать скорость прямой реакции, поэтому согласно принципа Ле-Шателье при понижениии концентрации Н2О равновесие сместится в сторону прямой реакции, т. е. в сторону увеличения образования Н2О.
б) При понижении давления смещение равновесия будет наблюдаться в сторону прямой реакции, так как объм газообразного реагента в полтора раза больше объема продукта реакции системы:
в) При повышении температуры равновесие сместится в сторону обратной реакции, так как прямая реакция – экзотермическая (∆Hx.p. = -484кДж). Согласно принципу Ле-Шателье равновесие реакции смещается в сторону уменьшения оказываемого на систему действия. Данная реакция протекает с выделением тепла (∆H
Задача 250.
Дано уравнение реакции: N2 + 3H2 = 2NH3
1) Укажите в какую сторону сместится равновесие системы. 2) Напишите выражение константы равновесия данной системы.
Решение:
1. При воздействии на систему равновесие смещается в сторону уменьшения этого воздействия. Так в системе :
N2 + 3H2 = 2NH3 из 4 объемов газообразных исходных веществ образуется 2 объема газообразного продукта, значит, при обычных условиях система протекает с уменьшением объема в 2 раза [4V(исх.в-ва)/2V(пр.) = 2]. Поэтому при повышении давления равновесие системы сместится в сторну прямой реакции, т.е. в сторону уменьшения воздействия на систему (уменьшения объема), на образование NH3, а при уменьшении давления — равновесие сместится в сторону увеличения воздействия на систему (увеличение объема), в сторону образовани исходных продуктов реакции (N2 и H2).
2. Выражение константы равновесия системы: N2 + 3H2 = 2NH3 будет иметь вид:
Отсюда находим константу равновесия реакции, получим:
Кр = [NH3] 2 /[N2] . [H2] 3 = (4) 2 /3 . (9) 3 = 16/2187 = 0,0073 или 7,3 . 10 -3 .
Задача 251.
Константа равновесия реакции А + В = С + D равна 1. Начальная конццентрация [А] = 0,01 моль/л, [В ]= 0,1 моль/л. Какая доля (в %) исходного количества вещества А подвергнется превращению при равновесии? Каковы равновесные концентрации веществ?
Решение:
Уравнение реакции имеет вид:
Из уравнения следует, что из 1 моля А и 1 моля В образуется по 1 молю С и D т.е. по 0,01 молю С и D.
Обозначим равновесную концентрацию С и D через х, тогда [С] = [D].
Таким образом, равновесные концентрации A и B будут составлять, соответственно, (0,01 – х) и (0,1 – х) моль/л, а С и D – по х моль/л. Подставим эти значения в выражение константы равновесия реакции:
Отсюда равновесные концентрации (моль/л):
[C]p = [D]p = х = 0,0091 моль/л;
[A]p = 0,01 – х = 0,01 – 0,0091 = 0,0009 моль/л;
[B]p = 0,1 – х = 0,1 – 0,0091 = 0,0909 моль/л.
Значит, 91% вещества А подвергнется превращению при равновесии.
0,01 — 100%
0,0091 — х
х = (0,0091 . 100%)/0,01 = 91%.
Задача 252.
В какую сторону сместится равновесие системы — PCl5(г) = PCl2(г) + Cl2(г), Н > 0:
а) при увеличении температуры;
б) при увеличении давления;
в) при увеличении концентрации хлора?
Решение:
а) прямая реакция эндотермическая (с поглощением тепла). Чтобы компенсировать увеличение температуры — должна пойти реакция с поглощением тепла. Смещение в сторону образования продуктов.
б) При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов.
Прямая реакция идет с увеличением числа молей газообразных веществ (увеличение давления). Обратная реакция с понижением давления. При увеличении давления пойдет реакция, уменьшающая его (обратная). Равновесие сместится влево.
в) При вводе в систему продукта реакции пойдет реакция, способствующая его расходу. Это обратная реакция. Равновесие сместится влево.
Задача 253.
При нагревании смеси углекислого газа и водорода образуется угарный газ и вода, а также устанавливаетася равновесие. При температуре 1123 К и константе скорости Кр = 1. Сколько молей углекислого газа необходимо на 1 моль водорода, чтобы 70% его превратилось в воду.
Решение:
Уравнение реакции имеет вид:
Из уравнения следует, что из 1 моля СО2 и 1 моля Н2 образуется по 1 молю СО и Н2О.
Находим количество Н2, которое вступило в реакцию: 1 . 0,7 = 0,7 моль/л. Остаток количества СО2 и Н2 одинаков и будет составлять 0,3 моль/л (1 – 0,7 = 0,3). Следовательно, из взятых веществ остаются непрореагировавшими 0,3 моля углекислого газа и 0,3 моля водорода:
Первоначальные количества реагирующих веществ (в молях)…. 1(СО2) : 1(Н2) = 0(СО) : 0(Н2О).
Количества веществ по достижении предела реакции 1123 К (в молях)…. 0,3(СО2) : 0,3(Н2) = 0,7(СО) : 0,7(Н2О)
Значит, причиной «остановки» разбираемой нами реакции является наличие обратной реакции.
После смешения углекислого газа с водородом между ними начинается взаимодействие, в результате которого образуются молекулы окиси углерода и воды. По мере течения этой реакции концентрации взятых веществ уменьшаются и скорость реакции становится все меньше и меньше. В то же время возникает возможность обратной реакции. Молекулы окиси углерода и воды, сталкиваясь между собой, могут снова превращаться в молекулы углекислого газа и водорода. Вначале, пока молекул окиси углерода и воды еще мало, их столкновения происходят довольно редко. Однако по мере накопления молекул этих веществ столкновения становятся все чаще, в результате чего скорость обратной реакции постепенно увеличивается. Наконец, наступает момент, когда скорости прямой и обратной реакций уравниваются, т. е. в каждую единицу времени исчезает столько же молекул углекислого газа и водорода, сколько их появляется вновь вследствие обратной реакции. С этого момента концентрации всех четырех газов перестают изменяться, несмотря на то, что первоначально взятые углекислый газ и водород целиком не прореагировали.
Таким образом, при температуре 1123 К в данной системе наступает равновесие когда на 1 моль водорода и на 1 моль углекислого газа прореагируют по о,7 моль этих веществ и образуется такое же количество угарного газа и воды, и в системе наступит равновесие при концентрациях веществ (в молях)….
Ответ: СО2 = 0,7 моль.
Тогда объёмные соотношения СО2 и Н2, к моменту наступления равновесия, составляют:
V(H2) : V(CO2) = 0,7 : 0,3 = 2,33 : 1. Значит, на 1 моль водорода необходимо 0,43 моль СО2 (1/2,33 = 0,429).
Источник
Напишите выражение для константы равновесия процессов:
Да, верно — в константу равновесия записывают только концентрации газов и жидкостей. Посему константа равновесия первого процесса будет: K = [CO2] — то есть концентрация CO2. Константа равновесия для обратного процесса равна K(обр) = 1/[CO2], кстати всегда выполняется правило K(обратной) = 1/K. Внимание! [CO2] — это не просто концентрация углекислого газа, а _равновесная_ — то есть в условиях установившегося равновесия.
Дополню насчет твердых веществ в константе равновесия — на самом деле, они тоже входят в выражение :))) Но на практике используют «эффективные» или «приведенные» константы равновесия, в которые уже входят концентрации твердых веществ. То есть, концентрации твердых веществ считют постоянными во все время процесса, и вносят эти значения в число константы, т. к. умножение или деление постоянных величин дает новую постоянную величину 🙂
И еще можно написать аналитическое выражение для констант равновесия, т. к. на практике трудно мерить равновесные концентрации. Итак, процесс находится в рановесии, когда энергия Гиббса равно 0, то есть
0 = (дельта) G = (дельта) G(нулевое) + R*T*ln(K) Откуда:
ln(K) = — (дельта) G(нулевое) / (R*T) = (T*(дельта) S(нулевое) — (дельта) H(нулевое) ) / (R*T)
где H — энтальпия, S — энтропия, Т — температура.
из ln(K) сама константа находится, взяв экспоненту от выражения из правой части равенства 🙂
Так что из табличных значений энтропии и энтальпии находится K равновесия для любой температуры.
Удачи!
Источник
Вычисление константы равновесия системы
Константа равновесия для гомогенной реакции
Задание 135.
Вычислите константу равновесия для гомогенной системы:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г)
если равновесные концентрации реагирующих веществ (молы/л):
[СО]р = 0,004; [Н2О]р = 0,064; [СО2]р = 0,016; [Н2]р = 0,016,
Чему равны исходные концентрации воды и СО? Ответ: Кр = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Решение:
Уравнение реакции имеет вид:
Kp = [CO2] . [H2]/ [CO] . [H2O]
Подставляя в выражение данные задачи получим:
Кр = (0,016 . 0,016)/(0,004 . 0,064) = 1.
Для нахождения исходных концентраций веществ Н2О и СО учтём, что согласно уравнению реакции из 1 моль СО и 1 моль Н2О образуется 1 моль СО2 и 1 моль Н2. Поскольку по условию задачи в каждом литре системы образовалось 0,016 моль СО2 и 0,016 моль Н2, то при этом было израсходовано по 0,016 моль СО и Н2О. Таким образом, искомые исходные концентрации равны:
Ответ: Кp = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Задание 136.
Константа равновесия гомогенной системы:
СО (г) + Н2О (г) ⇔ СО2 (г) + Н2 (г)
при некоторой температуре равна 1,00. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (молы/л): [СО]исх = 0,10; [Н2О]исх = 0,40.
Ответ: [СО2]Р = [Н2]Р = 0,08; [СO]P= 0,02; [Н2O]P = 0,32.
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Обозначаем за «х» моль/л равновесную концентрацию одного из продуктов реакции, тогда равновесная концентрация другого будет также х моль/л так как они оба образуются в одинаковом количестве. Равновесные концентрации исходных веществ будут:
[СО]исх = 0,10 – х моль/л; [Н2О]исх = 0,40 — х моль/л. (так как на образование х моль/л продукта реакции расходуется соответственно по х моль/л СО и Н2О. В момент равновесия концентрация всех веществ будет (моль/л): [СО2]Р = [Н2]Р = х; [СO]P= 0,10 — х; [Н2O]P = 0,4 – х.
Подставляем эти значения в выражение константы равновесия:
Решая уравнение, находим х = 0,08. Отсюда равновесные концентрации (моль/л):
Задание 137.
Константа равновесия гомогенной системы N2 + ЗН2 = 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Ответ: [N2]P = 8 молы/л; [N2]исх = 8,04 моль/л.
Решение:
Уравнение реакции имеет вид:
Обозначим равновесную концентрацию N2 через х моль/л. Выражение константы равновесия данной реакции имеет вид:
Подставим в выражение константы равновесия данные задачи и найдём концентрацию N2
Для нахождения исходной концентрации N2, учтём, что, согласно уравнению реакции на образование 1 моль NH3 затрачивается ½ моль N2. Поскольку по условию задачи в каждом литре системы образовалось 0,08 моль NH3, то при этом было израсходовано 0,08 . 1/2 = 0,04 моль N2. Таким образом, искомая исходная концентрация N2 равна:
Задание 138.
При некоторой температуре равновесие гомогенной системы
2NО + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ (молы/л): [NО]p = 0,2; [О2]р = 0,1; [NO2]р = 0,1. Вычислите константу равновесия и исходную концентрацию NO и O2. Ответ: К = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Решение:
Уравнение реакции:
Для нахождения исходных концентраций NO и O2 учтём, что согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO2, то при этом было затрачено 0,1 моль NO и 0,05 моль О2. Таким образом, исходные концентрации NO и О2 равны:
Ответ: Кp = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Смещение равновесия схимической системы
Задание 139.
Почему при изменении давления смещается равновесие системы:
N2 + 3Н2 ↔ 2NH3 и, не смещается равновесие системы N2 + O2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение:
а) Уравнение реакции:
Из уравнения реакции следует, что реакция протекает с уменьшением объёма в системе (из 4 моль газообразных веществ образуется 2 моль газообразного вещества). Поэтому при изменении давления в системе будут наблюдаться смещение равновесия. Если повысить давление в данной системе, то, согласно принципу Ле Шателье, равновесие сместится вправо, в сторону уменьшения объёма. При смещении равновесия в системе вправо скорость прямой реакции будет больше скорости обратной реакции:




Если же давление в системе уменьшить, то равновесие системы сместится влево, в сторону увеличения объёма, то при смещении равновесия влево скорость прямой реакции будет меньше, чем скорость прямой:

б) Уравнение реакции:
Из уравнения реакции следует, что при протекании реакции не сопровождается изменением объёма, реакция протекает без изменения числа молей газообразных веществ. Поэ му изменение давления в системе не приведёт к смещению равновесия, поэтому скорости прямой и обратной реакции будут равны:




Задание 140.
Исходные концентрации [NО]исх и [С12]исх в гомогенной системе
2NO + Сl2 ↔ 2NOС1 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО. Ответ: 0,417.
Решение:
Уравнение реакции имеет вид: 2NO + Сl2 ↔ 2NOС1
Согласно условию задачи в реакцию вступило 20% NO, что составляет 0,5 . 0,2 = 0,1 моль, а не прореагировало 0,5 – 0,1 = 0,4 моль NO. Из уравнения реакции следует, что на каждые 2 моль NO расходуется 1 моль Cl2, при этом образуется 2 моль NOCl. Следовательно, c 0,1 моль NO в реакцию вступило 0,05 моль Cl2 и образовалось 0,1 моль NOCl. Осталось не израсходованным 0,15 моль Cl2 (0,2 – 0,05 = 0,15). Таким образом, равновесные концентрации, участвующих веществ равны (моль/л):
Подставляя в данное выражение равновесные концентрации веществ, получим:
Ответ: Кр = 4,17.
Источник